Στην ιστορία της ιατρικής υπάρχουν στιγμές που μοιάζουν με το άνοιγμα ενός καινούριου βιβλίου. Στιγμές όπου η επιστήμη ύστερα από δεκαετίες αδιεξόδων, βρίσκει μια χαραμάδα φωτός. Μια τέτοια στιγμή φαίνεται πως ζούμε σήμερα, με την ανακοίνωση ότι για πρώτη φορά η νόσος του Χάντινγκτον, μία από τις πιο σκληρές και ανίατες νευροεκφυλιστικές παθήσεις αντιμετωπίστηκε επιτυχώς με γονιδιακή θεραπεία. Η είδηση αυτή δεν είναι απλώς ένα ακόμη ιατρικό δελτίο, αποτελεί υπόσχεση, προσδοκία και πρόκληση μαζί.
Η νόσος του Χάντινγκτον δεν είναι μια απλή πάθηση. Είναι μια γενετική καταδίκη που όταν εκδηλωθεί σβήνει σιγά-σιγά κάθε πτυχή της προσωπικότητας και της λειτουργικότητας του ασθενούς. Μνήμη που χάνεται, λόγος που μπερδεύεται, κίνηση που παραλύει. Δεν είναι μόνο η σταδιακή σωματική έκπτωση, είναι και η αίσθηση πως η ίδια η ταυτότητα του ανθρώπου διαβρώνεται, καθώς ο εγκέφαλος φθείρεται από μέσα. Για δεκαετίες οι γιατροί δεν μπορούσαν να κάνουν πολλά απλώς να μετριάσουν συμπτώματα, να καθυστερήσουν λίγο την πορεία προς το αναπόφευκτο.
Τώρα μια νέα γονιδιακή θεραπεία με το όνομα AMT-130 αναπτύσσεται από την ολλανδική εταιρεία βιοτεχνολογίας uniQure. Η θεραπεία δεν υπόσχεται θαύματα, αλλά κάνει κάτι εξαιρετικά σημαντικό: επιβραδύνει την εξέλιξη της νόσου και το κάνει στοχεύοντας απευθείας την αιτία της.
Οι ασθενείς με Χάντινγκτον έχουν μια μετάλλαξη που μετατρέπει την πρωτεΐνη huntingtin, κατά τα άλλα αθώα σε δηλητήριο. Η πρωτεΐνη συσσωρεύεται σε τοξικά σφαιρίδια μέσα στα εγκεφαλικά κύτταρα, τα οποία σταδιακά πεθαίνουν. Το AMT-130 σταματά αυτή την αλυσίδα. Μέσα από έναν αθώο ιό μεταφέρει στο εσωτερικό των κυττάρων ένα μικρό γενετικό μόριο, το λεγόμενο microRNA. Αυτό το μόριο λειτουργεί σαν μοριακό “σήμα στοπ”: μπλοκάρει τις οδηγίες που οδηγούν στην παραγωγή της τοξικής πρωτεΐνης. Έτσι η ασθένεια δεν εξαφανίζεται, αλλά επιβραδύνεται ριζικά.
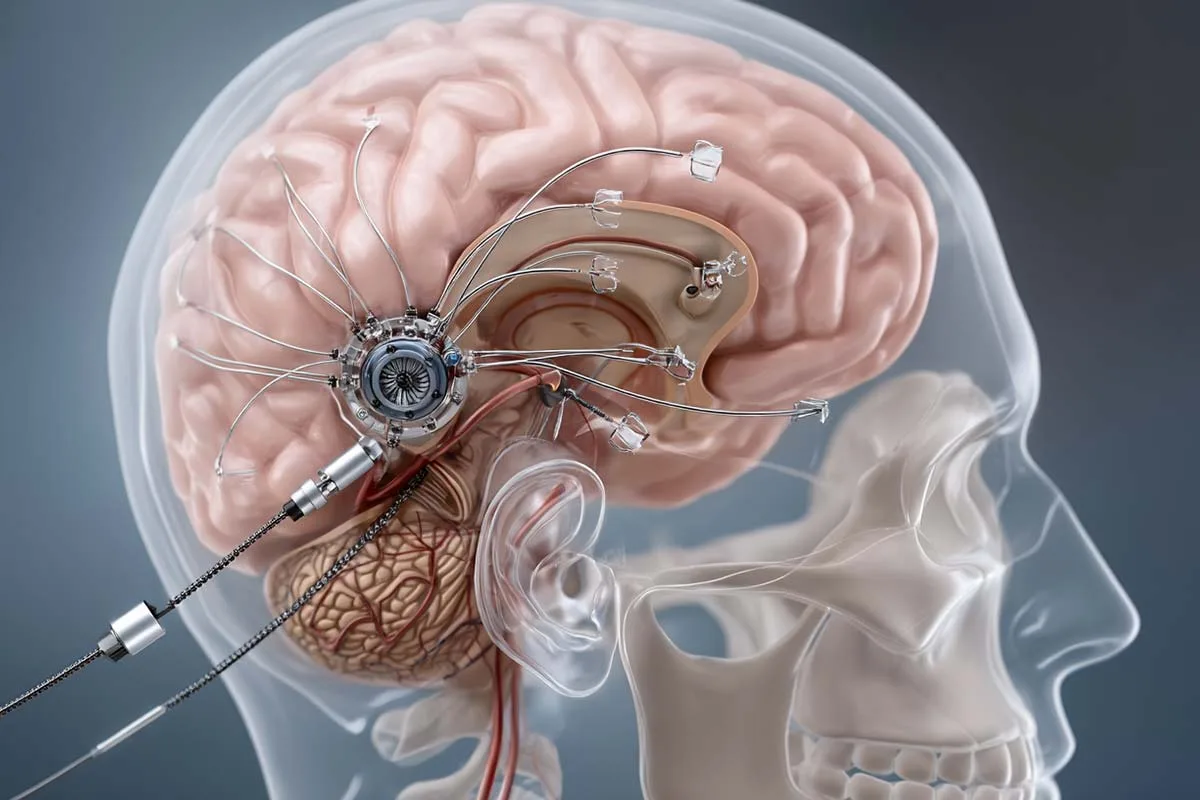
Η μέθοδος δεν είναι απλή. Το φάρμακο πρέπει να φτάσει σε δύο βαθιές περιοχές του εγκεφάλου. Οι γιατροί με τη βοήθεια ζωντανής απεικόνισης καθοδηγούν έναν καθετήρα σε αυτές τις δομές. Η διαδικασία διαρκεί 12 έως 18 ώρες, απαιτεί εξειδίκευση και αντοχή κι όμως μια μόνο ένεση φαίνεται να αρκεί για να μειώσει μόνιμα τα επίπεδα της μεταλλαγμένης πρωτεΐνης. Η πολυπλοκότητα της μεθόδου μαρτυρά τη σοβαρότητα του εγχειρήματος: δεν μιλάμε για ένα χάπι, αλλά για χειρουργική ακρίβεια μέσα στην καρδιά του εγκεφάλου.
Σε κλινική δοκιμή με 17 ασθενείς, που παρακολουθήθηκαν επί τρία χρόνια από την ομάδα της Σάρα Ταμπρίζι στο University College London τα αποτελέσματα ήταν εντυπωσιακά. Η εξέλιξη της νόσου επιβραδύνθηκε περίπου κατά 75%. Για να το πούμε απλά: ό,τι θα συνέβαινε σε έναν χρόνο σε ασθενείς χωρίς θεραπεία, συνέβη σε τέσσερα χρόνια σε όσους έλαβαν το AMT-130. Παράλληλα ανιχνεύτηκαν χαμηλότερα επίπεδα μιας πρωτεΐνης που συνδέεται με εγκεφαλική βλάβη, ένδειξη πως η θεραπεία όντως προστατεύει τον εγκέφαλο.
Οι παρενέργειες μέχρι στιγμής φαίνονται ήπιες: πονοκέφαλοι, σύγχυση, φλεγμονή που υποχωρεί με στεροειδή. Όμως όπως πάντα στην ιατρική τα πρώτα δεδομένα χρειάζονται επιβεβαίωση σε μεγαλύτερη κλίμακα.
Η uniQure αναμένεται να καταθέσει αίτηση στον FDA στις αρχές του 2026, με την ελπίδα ότι το φάρμακο θα κυκλοφορήσει πριν το 2027. Όμως η επιστημονική κοινότητα κρατά μικρό καλάθι. «Είναι ακόμη νωρίς», προειδοποιεί η Zosia Miedzybrodzka από το Πανεπιστήμιο του Aberdeen. «Χρειάζονται χρόνια μελετών για να δούμε πόσο διαρκούν τα οφέλη, πόσο καλά λειτουργεί μακροπρόθεσμα και τι άλλες παρενέργειες μπορεί να εμφανιστούν».
Αυτή η φωνή προσοχής δεν ακυρώνει τη σημασία της ανακάλυψης· τη βάζει στο πλαίσιο της ιατρικής πραγματικότητας, που ξέρει ότι κάθε νέο όπλο πρέπει να δοκιμαστεί σκληρά πριν δοθεί στους ασθενείς.
Αν το AMT-130 αποδειχθεί ασφαλές και αποτελεσματικό, τότε δεν θα είναι μόνο οι ασθενείς με Χάντινγκτον που θα ωφεληθούν. Η ίδια τεχνολογική προσέγγιση μπορεί να προσαρμοστεί σε άλλες ασθένειες του εγκεφάλου. Οι ερευνητές ήδη μιλούν για πιθανές θεραπείες στη νόσο του Πάρκινσον, στο Αλτσχάιμερ, σε άλλες μορφές άνοιας. Το μυστικό βρίσκεται στην αλλαγή του γενετικού μηνύματος: να στοχεύει κάθε φορά την τοξική πρωτεΐνη που καταστρέφει τα κύτταρα.
Μαζί με την ελπίδα τέτοιες ανακαλύψεις γεννούν και ερωτήματα. Αν η γονιδιακή θεραπεία γίνει πραγματικότητα ποιος θα έχει πρόσβαση; Θα είναι προνόμιο των λίγων ή δικαίωμα όλων; Πόσο θα κοστίζει μια τέτοια περίπλοκη επέμβαση και πώς θα καλυφθεί από τα συστήματα υγείας και σε ποιο βαθμό είμαστε έτοιμοι, ως κοινωνίες, να αποδεχτούμε ότι ο άνθρωπος μπορεί να παρεμβαίνει τόσο βαθιά στον γενετικό και νευρολογικό του πυρήνα;
Αυτά τα ερωτήματα δεν έχουν εύκολες απαντήσεις. Όμως είναι απαραίτητο να τεθούν, γιατί η ιατρική δεν είναι μόνο ζήτημα επιστημονικής ακρίβειας, αποτελεί ζήτημα κοινωνικής δικαιοσύνης και ηθικής ευθύνης.
Η γονιδιακή θεραπεία για τη νόσο του Χάντινγκτον είναι ένα από εκείνα τα βήματα που αλλάζουν τον χάρτη της ιατρικής. Όχι επειδή υπόσχεται άμεση ίαση, αλλά επειδή ανοίγει έναν νέο δρόμο. Μας δείχνει ότι ακόμη και οι πιο σκοτεινές, γενετικά προκαθορισμένες παθήσεις δεν είναι άτρωτες. Ότι μπορούμε να στείλουμε ένα “μοριακό σήμα στοπ” στην ίδια τη μοίρα. Αλλάζει κάτι τέτοιο την ουσία της ανθρώπινης κατάστασης; Ίσως όχι. Όμως αλλάζει τη σχέση μας με την ασθένεια, με τον χρόνο, με την ελπίδα και αυτή η αλλαγή είναι ήδη ανεκτίμητη.
*Με στοιχεία από το New Scientist.
➪ Ακολουθήστε το OLAFAQ στο Facebook, Bluesky και Instagram.